Kimyasal Türler Arası Etkileşimler
Kimyasal Türler Arası Etkileşimler , 9 sınıf kimya kimyasal türler arası etkileşimler konu anlatımı pdf , 9 sınıf kimya kimyasal türler
Kimyasal Tür Nedir?
Bir maddenin bütün özelliklerini taşıyan yapı taşlarına kimyasal tür denir. Dört çeşit kimyasal tür vardır: atom, molekül, iyon, radikal.
Atom
1 elementin fiziksel ve kimyasal özelliklerini gösteren en küçük birimine atom denir.
Atomlar fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamaz.
Nükleer yöntemlerle ayrıştırılabilirler.
Proton, nötron gibi tanecikler çekirdekte; elektronlar ise elektron bulutunda yer alır.
boyutlarının çok küçük olması nedeniyle optik mikroskoplarla görüntülenemez ancak elektron mikroskobu gibi araçlarla görüntülenebilir.
Molekül
Aynı cins veya farklı cins bir kaç atomun bir araya gelmesiyle oluşan yapılara molekül denir. En küçük molekülü iki atomludur.
Aynı tür atomların bir araya gelmesi sonucu element molekülü, farklı tür atomların bir araya gelmesiyle bileşik molekülü oluşur.
Bileşikler kimyasal yöntemlerle kendini oluşturan bileşenlere ayrışabilir.
Moleküller iki atomlu (diatomik), üç atomlu (triatomik) veya çok atomlu (poliatomik) olabilir.
İyon
Elektron sayısı proton sayısına eşit olmayan yapılara iyon denir.
Bir atom, elektron verdiğinde verdiği elektron sayısı kadar pozitif (+), Pozitif yüklü iyonlara katyon denir.
Elektron aldığında aldığı elektron sayısı kadar negatif (-) yükle yüklenir. Negatif yüklü iyonlara anyon denir.
Birden fazla atomun tek bir atom gibi davrandığı yüklü atom gruplarına kök adı verilir.
Bir atom elektron verip katyonuna dönüştüğünde çapı küçülür.
Elektron alıp anyonuna dönüştüğünde ise çapı büyür.
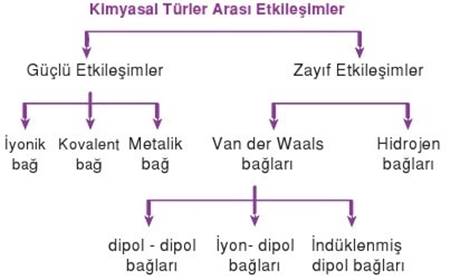
Kimyasal Türler Arası Etkileşimin Sınıflandırılması
Kimyasal türler arasında meydana gelen etkileşimler güçlü etkileşimler ve zayıf etkileşimler şeklinde ikiye ayrılır.
Güçlü Etkileşimler
Kimyasal türler arasındaki itme ve çekme kuvvetleri aynı anda gerçekleşir. Çekme kuvvetleri itme kuvvetlerinden çok fazla olduğunda türler arasında bir kimyasal bağ oluşur. Kimyasal türler arasında kimyasal bağ oluşmasına neden olan bu tür etkileşimler güçlü etkileşimler olarak da adlandırılır.
Güçlü etkileşimler,
İyonik bağ
Kovalent bağ
Metalik bağ olarak sınıflandırılır.
İyonik Bağ
Elektron alışverişi ile oluşan bağlara iyonik bağlar denir. İyonik bağların oluşumu, atomların farklı elektron çekme taleplerinden (elektronegatiflik) kaynaklanır. Elektron çekme arzusu daha fazla olan atomların protonlardan daha fazla elektronu vardır, bu nedenle bileşiğin anyonik kısmını oluştururken elektron veren kısım bileşiğin katyonik kısmını oluşturur. Örneğin günlük hayatımızdaki yaygın tuz (NaCl) bileşiği, sodyum (Na) katyonu (Na+) ve klorür (Cl) anyonu (Cl-) içeren iyonik bir bileşiktir.
Kovalent Bağ
Eliptik bağ, bir veya daha fazla elektronun paylaşılması ile karakterize edilen iki atom arasındaki kimyasal bağın tanımıdır. Genel olarak bir bağ, ortaya çıkan molekülleri bir arada tutan ortak çekim olarak tanımlanabilir. Paylaşılan elektron veya elektronlar iki çekirdeğin etrafında dolaşacak ve iki çekirdek arasındaki bölgede daha uzun kaldıkları için o bölgede (-) yüklü bir elektrik alan oluşturacaklardır. Bu alan iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ oluşturur. İki tür kovalent bağ vardır: polar kovalent bağlar ve polar olmayan kovalent bağlar.
Polar Olmayan Kovalent Bağ: Bağlı atomların elektronegatifliği eşit olduğunda oluşan bağ türüdür. Başka bir deyişle, iki atom aynı kuvvetteki elektronları çeker ve elektronlar üzerinde polar olmayan bir çekim oluşur. Aynı türden metalik olmayan iki atomun bir araya gelmesiyle oluşur. Polar olmayan kovalent bağa bir örnek; iki oksijen atomunun elektronlarının paylaşılmasıyla oluşan bir bağdır.
Polar Kovalent Bağ (Kutuplu Kovalent Bağ): İki farklı cins atomun bir araya gelmesiyle oluşur. Farklı atomlar oldukları için oluşan elektronegativite farkı, atomlardan elektronegativitesi yüksek olanın kısmi negatif, diğerinin ise kısmi pozitif yüklenmesini sağlar. Örneğin suyu meydana getiren hidrojen ve oksijen moleküllerinin son orbitallerindeki elektronların ortak kullanılmasıyla polar kovalent bağ meydana gelir.
Metalik Bağ
Metalik bağ, esas olarak metaller arasındaki, bir ya da daha çok atomu bir arada tutan bir kimyasal bağ türüdür. Metal atomlarının latisindeki serbest elektronların yer değiştirmiş olarak paylaşılması esasına dayanır. Metalik bağ, kovalent bağ ve iyonik bağ ile birlikte üç güçlü etkileşimden(bağ) biridir. Kimyasal bir etkileşimdir.
Aynı periyotta sağa doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
Aynı grupta yukarı doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
Elektron denizinde serbest dolaşan değerlik elektron sayısı arttıkça metalik bağ kuvveti artar.
Zayıf etkileşim
Zayıf etkileşimler, madde molekülleri arasında etkili olan fiziksel bağlardır. Zayıf etkileşimler van der Waals kuvvetleri ve hidrojen bağları olarak ikiye ayrılır.
Van der Waals kuvvetleri
Van der Waals kuvvetleri, hidrojen bağları dışındaki zayıf etkileşimlerdir. Bu kuvvetler, Hollandalı fizikçi Johannes Diderik van der Waals’ın (1837-1923) adını almıştır.
Üç tür van der Waals kuvveti vardır:
Polar moleküller arasındaki dipol-dipol etkileşimleri
Polar moleküller ve iyonlar arasındaki iyonik-dipol etkileşimleri
Polar olmayan moleküller arasındaki London kuvveti
Dipol-dipol etkileşimi: Kalıcı dipollere sahip polar kimyasallar birbirine yaklaştırıldığında, birinin pozitif kısmı (δ+) ve diğerinin kısmı negatif (δ-) arasında elektrostatik bir çekim oluşur. Bu yerçekimi kuvvetine dipol-dipol bağı (kuvvet) denir.

Hidrojen Bağları
Hidrojen bağı, bir molekül oksijen, azot veya flor gibi elektronegatif bir atoma bağlı hidrojenin kısmi artı yükle yüklenmesi sonucu, başka veya aynı moleküldeki elektronegatif atom ile yaptığı kuvvetli bağdır.
