Atom ve Periyodik Sistem
BÖLÜM: ATOM MODELLERİ
DALTON ATOM MODELİ – 1803
• Madde atom adı verilen taneciklerden oluşur.
• Atomlar parçalanamaz, yoktan var edilemez, yok
edilemez, başka bir atoma dönüşemez.
• Kimyasal tepkimelerde atom sayısı ve türü
değişmez.
• Atom içi dolu küre şeklindedir.
• Bir elementin bütün atomları özdeştir.
• Farklı element atomları birbirinden farklıdır.
• Bileşik oluşurken element atomları belirli oranlarda
birleşir.
Varsayımları:
Günümüzden Bakış
• Atom altı tanecikler vardır.
• Radyoaktivite ile atom parçalanabilir.
• Atomun büyük bir bölümü boşluktur.
• Bir elementin bütün atomları aynı değildir (izotop atomlar).
İçi dolu küre
(Bilardo topu)

THOMSON ATOM MODELİ – 1897
• Atom, yaklaşık 10-8 m çapa sahip küredir.
• Elektronlar pozitif yük içinde homojen dağılmıştır.
• Elektron sayısı pozitif yük sayısına eşittir ve atom
nötrdür.
• Elektronların kütlesi ihmal edilir, atomun kütlesini
protonlar oluşturur.
• Katot ışınları deneyi ile elektronun varlığını
kanıtlamıştır.
Varsayımları:
Günümüzden Bakış
• Pozitif ve negatif yükler homojen dağılmaz.
• Yükler dağınık halde değildir. Pozitif yükler
çekirdekte yoğunlaşmıştır.
• Pozitif tanecikler atom ağırlığının yarısı kadardır.

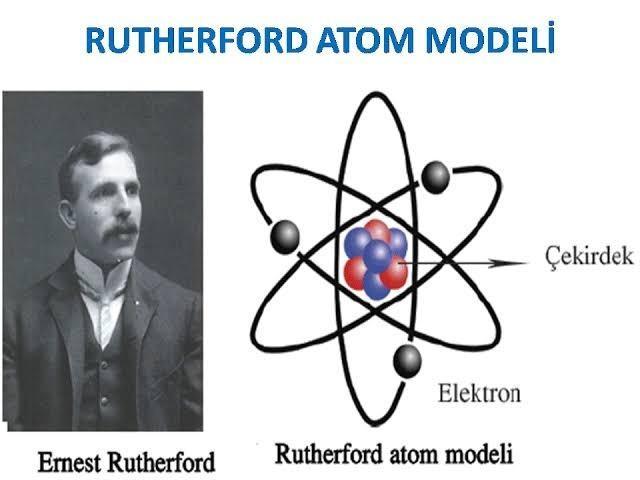
RUTHERFORD ATOM MODELİ – 1911
ALFA SAÇILMASI
• Bu deney ile pozitif yüklerin atomun merkezinde
küçük bir hacimde toplandığını kanıtladı. Bu
merkeze çekirdek adını verdi.
Alfa Saçılması (Altın Levha) Deneyi
Üzümlü kek
++++ + +
- Gezegen modeli Alfa ışın
kaynağı
Altın levha Sapan
ışınlar
Sapmayan
ışınlar
Sapan ışınlar: Çekirdek
Sapmayan ışınlar: Boşluk
• Bu deney ile pozitif yüklerin atomun merkezinde
küçük bir hacimde toplandığı
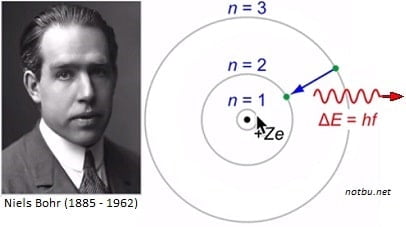
BOHR ATOM MODELİ – 1913
Bu modele göre,
• Elektronlar çekirdekten belirli uzaklıklardaki
yörüngelerde bulunur. Bu yörüngelere, enerji düzeyi
kabuk ya da katman da denir.
• Enerji düzeyleri K,L,M,N ya da 1,2,3,4 gibi harf veya
sayılarla ifade edilir.
• Çekirdekten uzaklaştıkça yörüngelerin ve elektronların enerjisi artar
Hidrojen Atomunun Spektrumu
Yayılan ışığın enerjisi iki enerji düzeyi arasındaki farka
eşittir ve ile ΔE: Eyüksek – Edüşük hesaplanır.
Yörüngeli model
I ve III: Temel hâl
II: Uyarılmış hâl
a: Emisyon (ışık yayılır)
b: Absorbsiyon (enerji alınır)
a
b
a: H atomunun absorbsiyon spektrumu
b: H atomunun emisyon spektrumu
Atomların spektrumları karakteristiktir ve çizgi ya da
kesikli spektrum olarak adlandırılır. Beyaz ışığın
prizmadan geçirilerek renklerine ayrılması sürekli
spektrumdur.
BÖLÜM: ATOMUN YAPISI
ATOMU OLUŞTURAN TEMEL TANECİKLER
- Proton: Çekirdekte bulunan pozitif yüklü taneciklerdir.
- Nötron: Çekirdekte bulunan yüksüz taneciklerdir.
- Elektron: Çekirdeğin çevresinde hareket eden negatif
- yüklü taneciklerdir.
- ATOMLA İLGİLİ TERİMLER
- Kütle Numarası (A): Çekirdekteki proton ve nötron
- sayılarının toplamıdır. Nükleon sayısı olarak da bilinir.
- Atom Numarası (Z): Çekirdekteki proton sayısıdır.
- İyon yükü: Bir atom elektron aldığında (-) yüklü iyon,
- elektron verdiğinde (+) yüklü iyon oluşturur.
- İzotop, İzoton, İzobar ve İzoelektronik Tanecikler
- İzotop atomlar: Proton sayısı aynı, kütle numarası farklı
- atomlardır.
- İzotop atomların kimyasal özellikleri aynı, fiziksel
- özellikleri farklıdır.
- İzoton atomlar: Nötron sayısı aynı, proton sayısı farklı
- atomlardır.
- İzobar atomlar: Kütle numarası aynı, proton ve elektron
- sayısı farklı atomlardır.
- İzoelektronik tanecikler: Elektron sayısı ve dizilimi aynı
- olan taneciklerdir.
